Conheça o remédio de R$ 8 milhões que tenta corrigir falhas do DNA
Bebê em incubadora neonatal
Agência norte-americana deu aval ao medicamento Zolgensma para tratar bebês com amiotrofia muscular espinhal (AME). O remédio –com preço que pode passar de US$ 2 milhões, ou R$ 8 milhões,– é capaz de corrigir gene que leva a casos de AME pediátricas. Quatorze dos 15 bebês que testaram o Zolgensma apresentaram melhoras
Quanto você pagaria por uma dose de um remédio? E se esse dose única fosse capaz de tratar uma doença normalmente letal em bebês? E se essa dose única fosse capaz de curar completamente essa doença? O FDA (agência norte-americana responsável pela regulamentação de medicamentos) deu, na semana passada, aval ao medicamento Zolgensma para tratar bebês com amiotrofia muscular espinhal (AME). A terapia usa uma dose só. O preço dessa dose pode passar de US$ 2 milhões, ou R$ 8 milhões.
Fragmento Tudor, da proteína SMN
A AME é uma doença degenerativa com causas genéticas. Em pessoas saudáveis, uma proteína chamada SMN regula uma grande variedade de atividades de internas de neurônios motores, neurônios esses que controlam a atividade de músculos. A AME acontece quando uma pessoa tem uma deleção no gene smn1, principal responsável por produzir a proteína SMN dentro das células. Essa deficiência da proteína acaba causando problemas neuro-musculares.
Em adultos e jovens (AME tipos 3 e 4 na tabela abaixo), essa doença pode causar comprometimento da musculatura e problemas de locomoção, afetando a qualidade de vida. Já a versão pediátrica dessa doença (AME tipos 1 e 2 na tabela abaixo) é mais dramática. Bebês que apresentam sintomas da doença entre os seis a 18 meses correm risco de sofrer problemas crônicos respiratórios e musculares por toda a vida, e muitos acabam morrendo antes de atingir a adolescência.
Bebês que apresentam sintomas da doença nos seis primeiros meses de vida, em sua maioria, precisam de suporte de aparelhos para respirar antes de atingir dois anos de idade. Uma quantidade bastante pequena desses bebês chegam aos três anos de vida. Diante desse cenário, um remédio capaz de tratar um caso de AME pediátrica pode ser a diferença entre morrer durante a infância ou levar uma vida plena.
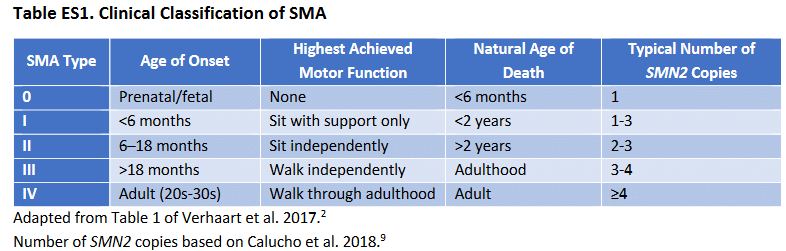
Tabela extraída deste relatório
O recém-autorizado Zolgensma é uma terapia genética que tenta resolver a deficiência do gene smn1. O remédio é um vírus artificial produzido em laboratório (adenovírus AA9) que carrega uma cópia do gene smn1.
A aplicação da terapia acontece através da injeção desse vírus artificial. O Zolgensma injeta cópias do gene smn1 nas células dos neurônios que dele precisam, e a célula passa a produzir a proteína SMN em quantidades suficientes. A versão do gene injetado nas células foi desenhada para ser estável e permanecer lá.
Como neurônios não se reproduzem, o smn1 injetado não precisa ser replicado, ao menos em tese. O resultado é que a deficiência do SMN causada pela deleção do smn1 nativo seria completamente suprida pelo smn1 exógeno do Zolgensma.
Vírus AAV2, "parente" do vírus AA9
O estudo piloto (financiado pela Novartis, que desenvolveu o remédio), analisou o efeito do remédio em 15 pacientes com AME tipo 1. O remédio aparentou eficácia: 14 dos 15 bebês chegaram ao final do estudo de dois anos sem precisar de apoio contínuo de ventilação mecânica, e o décimo quinto paciente foi eventualmente capaz de respirar sem aparelhos. A taxa natural desse tipo de resultado é de apenas 8%. Ganhos significativos e substanciais de função motora e autonomia respiratória também foram observados.
Esses resultados ainda são preliminares, é claro. Mas é impossível não notar que esse medicamento é um marco importante no progresso da engenharia genética como terapia. A única outra terapia genética autorizada na lista do FDA é a Luxturna.
Mas e os US$ 2 milhões? Não é muito dinheiro pra se cobrar por uma vida? Essa questão é complicadíssima.
Primeiramente, o preço em si, sob a perspectiva do preço de oferta, não é completamente absurdo. Desenvolver um remédio é caro: é preciso pagar salários pros pesquisadores, arcar com o custo de equipamentos e insumos utilizados, financiar testes de segurança e eficácia do medicamento, e subsídio de outros remédios fracassados.
Um instituto independente que avalia a razoabilidade de preços de remédios fez um estudo recomendando que o preço mais correto pra esse remédio seria de US$ 1,5 milhão. É menos que o preço sugerido pela Novartis, mas ainda assim bastante alto. Para termos uma outra referência, o Luxturna custa US$ 850 mil. O patamar de preços não está tão desalinhado assim.
Mas para o paciente, essas quantias é ridícula. A renda mediana anual nos EUA é US$ 60 mil. Esse americano levaria 30 anos pra pagar um remédio de US$ 2 milhões se gastasse todo seu salário com a dose única. Um brasileiro que recebe um salário mínimo levaria mais de 600 anos para cobrir essa conta, se não tivesse apoio algum do SUS. Isso aí é um problemão.
Nessa questão, eu gosto de olhar esse tipo de questão sob uma perspectiva diferente. Pra mim, a mera existência desse remédio já é uma conquista enorme e o foco no custo pode acabar sendo um "close errado".
Sim, o preço do remédio é proibitivo pra muita gente que poderia se beneficiar dele. Mas sem o desenvolvimento, o remédio sequer existiria. Dito de outra forma, o desenvolvimento reduziu o custo do medicamento de "inexistente" para "US$ 2 milhões". Além disso, com o tempo, o custo do medicamento tende a cair, seja por expiração de patentes ou direitos de exclusividade, seja por negociações entre farmacêuticas, seguradoras ou governos.
Na marcha da história da tecnologia, esses preços absurdos acabam sendo solavancos resolvidos com o tempo –e o que fica é a terapia em si. Nesse caso, uma terapia que pode ser a diferença entre morrer antes dos dois anos ou virar um adulto.
Sobre os autores
Monica Matsumoto é cientista e professora de Engenharia Biomédica no ITA. Curiosa, ela tem interesse em áreas multidisciplinares e procura conectar pesquisadores em diferentes campos do conhecimento. Monica é formada em engenharia pelo ITA e doutora em ciências pela USP, e trabalhou em diferentes instituições como InCor/HCFMUSP, UPenn e EyeNetra.
Shridhar Jayanthi é Agente de Patentes com registro no escritório de patentes norte-americano (USPTO) e tem doutorado em Engenharia Elétrica pela Universidade de Michigan (EUA) e diploma de Engenheiro de Computação pelo ITA. Atualmente, ele trabalha com empresas de alta tecnologia para facilitar obtenção de patentes e, nas (poucas) horas vagas, é um estudante de problemas na intersecção entre direito, tecnologia e sociedade. Antes disso, Shridhar teve uma vida acadêmica com passagens pela Rice, MIT, Michigan, Pennsylvania e no InCor/USP, e trabalhou com pesquisa em áreas diversas da matemática, computação e biologia sintética.














ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.